Localisation cellulaire protéine
Contents:C'est la structure tertiaire de la protéine et la nature chimique des chaînes latérales des résidus d' acides aminés du site de liaison qui déterminent la spécificité de cette interaction. Les sites de liaison peuvent conduire à des liaisons particulièrement spécifiques et étroites: Une légère modification chimique peut radicalement modifier la faculté d'une molécule à interagir avec une protéine donnée.
Ainsi l' aminoacyl-ARNt synthétase spécifique de la valine se lie à cette dernière sans interagir avec l' isoleucine , qui lui est pourtant structurellement très proche [ 23 ]. Les protéines peuvent se lier selon les cas à d'autres protéines ou à de petites molécules comme substrats. Lorsqu'elles se lient spécifiquement à d'autres protéines identiques à elles-mêmes, elles peuvent polymériser pour former des fibrilles.
Ceci est fréquent pour les protéines structurelles, formées de monomères globulaires qui s' auto-assemblent pour former des fibres rigides. Des interactions protéine-protéine régulent également leur activité enzymatique , l'avancement du cycle cellulaire et l'assemblage de grands complexes protéiques réalisant des réactions étroitement apparentées partageant une fonction biologique commune. Les protéines peuvent également se lier à la surface des membranes cellulaires et même fréquemment en faire partie intégrante.
La capacité de certaines protéines à changer de conformation lorsqu'elles se lient à des molécules spécifiques permet de construire des réseaux de signalisation cellulaire extrêmement complexes. D'une manière générale, l'étude des interactions entre protéines spécifiques est un élément clé de notre compréhension du fonctionnement des cellules et de leur faculté à échanger de l'information [ 24 ] , [ 25 ].
Le rôle le plus visible des protéines dans la cellule est celui d' enzyme , c'est-à-dire de biomolécule catalysant des réactions chimiques. Les enzymes sont généralement très spécifiques et n'accélèrent qu'une ou quelques réactions chimiques. La très grande majorité des réactions chimiques du métabolisme sont réalisées par des enzymes. Certaines enzymes agissent sur d'autres protéines pour y lier ou en cliver certains groupes fonctionnels et des résidus d'autres biomolécules, selon un processus appelé modification post-traductionnelle. Les molécules qui se lient aux enzymes et sont modifiées chimiquement par elles sont appelées substrats.
Bien que les enzymes soient parfois constituées de plusieurs centaines de résidus d'acides aminés, seuls quelques-uns d'entre eux entrent en contact avec le ou les substrats de l'enzyme, et un très petit nombre — généralement trois ou quatre — sont impliqués directement dans la catalyse.
On appelle site actif la région d'une enzyme impliquée dans la réaction chimique catalysée par cette protéine: De nombreuses protéines sont impliquées dans les mécanismes de signalisation cellulaire et de transduction de signal. Certaines protéines telles que l' insuline appartiennent au milieu extracellulaire et transmettent un signal de la cellule où elles sont synthétisées vers d'autre cellules parfois situées dans des tissus éloignés. D'autres sont des protéines membranaires qui agissent comme récepteurs dont la fonction principale est de se lier aux molécules porteuses de signaux et d'induire une réponse biochimique dans la cellule cible.
De nombreux récepteurs membranaires ont un site de liaison exposé à l'extérieur de la cellule et un domaine effecteur en contact avec le milieu intracellulaire. Ce domaine effecteur peut être porteur d'une activité enzymatique ou peut subir des changements conformationnels agissant sur d'autres protéines intracellulaires. Les anticorps sont les constituants protéiques du système immunitaire dont la fonction principale est de se lier aux antigènes ou aux xénobiotiques afin de les marquer pour élimination par l'organisme.
Les anticorps peuvent être sécrétés dans le milieu extracellulaire ou bien ancrés dans la membrane plasmique de lymphocytes B spécialisés appelés plasmocytes. De nombreuses protéines transporteuses de ligands se lient spécifiquement à de petites molécules et les transportent à destination à travers les cellules et les tissus des organismes multicellulaires. Ces protéines doivent posséder une forte affinité pour leur ligand lorsque la concentration de celui-ci est élevée, mais doivent également pouvoir le libérer lorsque sa concentration est faible dans les tissus cibles.
L'exemple canonique de la protéine porteuse de ligand est l' hémoglobine , qui transporte l' oxygène des poumons vers les autres organes et tissus chez tous les vertébrés et a des homologues apparentés dans tous les règnes du vivant. Les lectines sont des protéines qui se lient réversiblement à certains glucides avec une très grande spécificité. Elles jouent un rôle dans les phénomènes de reconnaissance biologique impliquant cellules et protéines [ 29 ]. Les protéines transmembranaires peuvent également jouer le rôle de protéines transporteuses de ligands susceptibles de modifier la perméabilité de la membrane plasmique aux petites molécules polaires et aux ions.
Les protéines membranaires peuvent ainsi contenir un ou plusieurs canaux à travers la membrane cellulaire et permettant à ces molécules et à ces ions de la traverser. De nombreux canaux ioniques sont très spécifiques de l'ion dont ils permettent la circulation.
Ainsi, les canaux potassiques et les canaux sodiques sont souvent spécifiques de l'un des deux ions potassium et sodium à l'exclusion de l'autre. Les protéines structurelles confèrent raideur et rigidité à des constituants biologiques qui, sans elles, seraient fluides.
La plupart des protéines structurelles sont fibreuses. C'est par exemple le cas du collagène et de l' élastine qui sont des constituants essentiels de tissus conjonctifs tels que le cartilage , et de la kératine présente dans les structures dures ou filamenteuses telles que les poils , les ongles , les plumes , les sabots et l' exosquelette de certains animaux. Certaines protéines globulaires peuvent également jouer un rôle structurel, par exemple l' actine et la tubuline dont les monomères sont glubulaires et solubles mais polymérisent pour former de longs filaments rigides constituant le cytosquelette , ce qui permet à la cellule de maintenir sa forme et sa taille.
Les protéines motrices sont des protéines structurelles particulières qui sont capables de générer des forces mécaniques. Ce sont par exemple la myosine , la kinésine et la dynéine. Ces protéines sont essentielles à la motilité des organismes unicellulaires ainsi qu'aux spermatozoïdes des organismes multicellulaires.
Les protéines remplissent ainsi des fonctions très diverses au sein de la cellule et de l'organisme [ 30 ]:. La structure et les fonctions des protéines peuvent être étudiées in vivo , in vitro et in silico. Les études in vivo permettent d'explorer le rôle physiologique d'une protéine au sein d'une cellule vivante ou même au sein d'un organisme dans son ensemble.
Les études in vitro de protéines purifiées dans des environnements contrôlés sont utiles pour comprendre la façon dont une protéine fonctionne in vivo: Les études in silico utilisent des algorithmes informatiques pour modéliser des protéines. Pour pouvoir être analysée in vitro , une protéine doit préalablement avoir été purifiée des autres constituants chimiques de la cellule. Ceci commence généralement par la lyse de la cellule, au cours de laquelle la membrane plasmique est rompue afin d'en libérer le contenu dans une solution pour donner un lysat.
Ce mélange peut être purifié par ultracentrifugation , ce qui permet d'en séparer les constituants en fractions contenant respectivement les protéines solubles, les lipides et protéines membranaires , les organites cellulaires, et les acides nucléiques. La précipitation des protéines par relargage permet de les concentrer à partir de ce lysat. Il est alors possible d'utiliser plusieurs types de chromatographie pour isoler les protéines que l'on souhaite étudier en fonction de leurs propriétés physico-chimiques telles que leur masse molaire , leur charge électrique , ou encore leur affinité de liaison.
Les protéines naturelles requièrent éventuellement une série d'étapes de purification avant de pouvoir être étudiées en laboratoire. Afin de simplifier ce procédé, le génie génétique est souvent utilisé pour modifier les protéines en les dotant de caractéristiques qui les rendent plus faciles à purifier sans pour autant altérer leur structure ni leur activité.
De ce fait, lorsque le lysat est placé dans une colonne chromatographique contenant du nickel , les résidus d'histidine se complexent au nickel et restent liées à la colonne tandis que les constituants dépourvus d'étiquette la traversent sans être arrêtés. Plusieurs types d'étiquettes ont été développés afin de permettre aux chercheurs de purifier des protéines particulières à partir de mélanges complexes [ 32 ].
L'étude in vivo des protéines implique souvent de savoir précisément où elles sont synthétisées et où elles se trouvent dans les cellules. Bien que la plupart des protéines intracellulaires soient produites dans le cytoplasme et que la plupart des protéines membranaires ou sécrétées dans le milieu extracellulaire sont produites dans le réticulum endoplasmique , il est rare qu'on comprenne précisément comment les protéines ciblent spécifiquement certaines structures cellulaires ou certains organites.
Le génie génétique offre des outils utiles pour se faire une idée de la localisation de certaines protéines, par exemple en liant la protéine étudiée à une protéine permettant de la repérer, c'est-à-dire en réalisant une protéine de fusion entre la protéine étudiée et une protéine utilisée comme marqueur, telle que la protéine fluorescente verte [ 33 ]. La localisation intracellulaire de la protéine de fusion résultante peut être facilement et efficacement visualisée par microscopie [ 34 ].
D'autres méthodes de localisation intracellulaire des protéines impliquent l'utilisation de marqueurs connus pour certains compartiments cellulaires tels que le réticulum endoplasmique , l' appareil de Golgi , les lysosomes , les mitochondries , les chloroplastes , la membrane plasmique , etc. Il est par exemple possible de localiser des protéines marquées avec une étiquette fluorescente ou ciblées avec des anticorps contre ces marqueurs. Les techniques d' immunofluorescence permettent ainsi de localiser des protéines spécifiques. Des pigments fluorescents sont également utilisés pour marquer des compartiments cellulaires dans un but similaire [ 35 ].
L' immunohistochimie utilise généralement un anticorps ciblant une ou plusieurs protéines étudiées qui sont conjugués à des enzymes émettant des signaux luminescents ou chromogènes pouvant être comparés à divers échantillons, ce qui permet d'en déduire des informations sur la localisation des protéines étudiées. Il est également possible d'utiliser des techniques de cofractionnement dans un gradient de saccharose ou d'une autre substance à l'aide d'une centrifugation isopycnique.
La microscopie immunoélectronique combine l'utilisation d'une microscopie électronique classique à l'utilisation d'un anticorps dirigé contre la protéine étudiée, cet anticorps étant préalablement conjugué à un matériau à forte densité électronique telle que l' or. Ceci permet de localiser des détails ultrastructurels ainsi que la protéine étudiée [ 36 ].
L'ensemble des protéines d'une cellule ou d'un type de cellule constitue son protéome , et la discipline scientifique qui l'étudie est la protéomique. Ces deux termes ont été forgés par analogie avec le génome et la génomique. Si le protéome dérive du génome, il n'est cependant pas possible de prédire exactement quel sera le protéome d'une cellule à partir de la simple connaissance de son génome.
En effet, l' expression d'un gène varie d'une cellule à l'autre au sein d'un même organisme en fonction de la différenciation cellulaire , voire dans la même cellule en fonction du cycle cellulaire. Par ailleurs, un même gène peut donner plusieurs protéines par exemple les polyprotéines virales , et des modifications post-traductionnelles sont souvent nécessaires pour rendre une protéine active.
L'ensemble des interactions protéine-protéine d'une cellule est appelé interactome [ 41 ].
Localisation de protéines dans la cellule
Il existe à présent tout un ensemble de méthodes informatiques permettant d'analyser la structure, la fonction et l'évolution des protéines. Le développement de tels outils a été rendu nécessaire par la grande quantité de données génomiques et protéomiques disponibles pour un très grand nombre d'êtres vivants, à commencer par le génome humain.
Il est impossible d'étudier toutes les protéines expérimentalement, de sorte que seules un petit nombre d'entre elles font l'objet d'études au laboratoire tandis que les outils de calcul permettent d'extrapoler les résultats ainsi obtenus à d'autres protéines qui leur sont semblables. De telles protéines homologues sont efficacement identifiées par les techniques d' alignement de séquences.
Des outils de profilage des séquences peptidiques permettent de localiser les sites clivés par les enzymes de restriction , les cadres de lecture dans les séquences nucléotidiques , et de prédire les structures secondaires. Les outils bio-informatiques sont devenus indispensables à l'étude des gènes et des protéines exprimées par ces gènes. En plus de la génomique structurelle, la prédiction de la structure des protéines vise à développer des moyens permettant d'élaborer efficacement des modèles plausibles décrivant la structure de protéines qui n'ont pu être résolues expérimentalement [ 43 ].
Le but de la génomique structurelle est de fournir suffisamment de données sur les structures résolues afin de permettre l'élucidation de celles qui restent à résoudre [ 44 ]. Un problème plus complexe à résoudre par le calcul est la prédiction des interactions intermoléculaires, comme la prédiction de l'ancrage des molécules et des interactions protéine-protéine [ 47 ].
Les résidus hydrophobes de l'hélice du segment d'activation interagissent avec l'hélice-C du lobe N-terminal et la stabilise dans sa conformation inactive, c'est-à-dire incapable de bien positionner les groupes phosphoryles de l'ATP. Plus avant dans le segment d'activation, les résidus forment une hélice qui positionne la tyr près de la boucle catalytique et, en prenant la place du substrat, bloque le site catalytique. La trans-autophosphorylation de la Tyr s'ensuit, repositionnant ainsi le segment d'activation. L'activité kinasique est multipliée par Pour en savoir plus sur Src et la découverte de la phosphorylation de tyrosine:.
Purifiée à partir du muscle de lapin, l'enzyme fut caractérisée sous deux états fonctionnels, la phosphorylase a et phosphorylase b qui différaient sur deux points: Par la suite, les Cori découvrirent une enzyme capable, in vitro, de convertir la phosphorylase a active en phosphorylase b moins active. L'attribution erronée de ce rôle au groupe prosthétique était justifiée vu que la notion d'allostérie et donc le changement de l'activité dû à la fixation des facteurs aux sites non-catalytiques de l'enzyme, n'avait pas encore été formulée.
En automne , Fisher et Krebs commençèrent à travailler ensemble dans le nouveau Département de Biochimie, University of Washington, à Seattle, sur le mécanisme encore inconnu de l'effet stimulant de 5'-AMP sur la phosphorylase b et de son inefficacité sur la phosphorylase a forme active. Au cours de leurs premiers essais, ils échouèrent dans leur tentative de purifier, par cristallisation selon la procédure de Cori, la phosphorylase a. Plus étonnant était l'observation que dans son état partiellement pur, la phosphorylase était entièrement dans la forme b peu active.
Selon le propos de Krebs:. Bien que ceci semblait être un changement mineur, nous avons néanmoins inclus l'étape de filtration dans notre préparation ultérieure de la phosphorylase. A notre grande surprise, cette fois nous obtînmes de la phosphorylase a facilement cristallisée, telle qu'elle devait être. Deux conclusions pouvaient être tirées pour expliquer les résultats. Revenant sur l'existence de l'enzyme PR, antérieurement découverte par les Cori, ils démontrèrent que cette enzyme est capable de libérer le phosphate inorganique Pi ou H 2 PO4 - et peut donc s'identifier en tant que phosphorylase phosphatase PP1G.
Dès ce moment, on a pu considérer que phosphorylation et déphosphorylation sont des processus capables d'altérer l'activité enzymatique.
Re : Localisation de protéines dans la cellule
En d'autres termes, la phosphorylation peut être rangée parmi les modifications allostériques. Dans la fin de la décennie on pouvait écrire les équations d'interconversion des phosphorylases musculaires, comme suit:. The phosphorylase b to a converting enzyme of rabbit skeletal muscle. Fischer and Edwin G.
- google localisation telephone?
- !
- Détermination de la localisation cellulaire des protéines par l.
- Localisation de protéines dans la cellule!
- Protéine — Wikipédia!
Biochimica et Biophysica Acta, Volume , , Pages Cette excursion montre des tableaux récapitulant en détail les différentes familles de protéine kinases ainsi que l'architecture des domaines protéiques. Certaines fonctionnalités de ce module sont restreintes. Introduction à la signalisation cellulaire [biologie cellulaire]. La phosphorylation et la déphosphorylation. Phosphorylation due aux protéines kinases.
Déphosphorylation et protéine phosphatases.
Détermination de la localisation cellulaire des protéines par l
Phosphorylation due aux protéines kinases Les gènes codant les protéines kinases sont remarquablement abondants: Régulation de l'activité des protéines kinases. Differents mécanismes de l'activité des protéines kinases. Pour en savoir plus: Un article qui montre l'importance de la régulation spatiale des enzymes: Mécanismes d'activation des protéines kinases. Nous verrons le mécanisme général d'activation avec les exemples détaillés de trois types de protéines kinases: Figure E10 Motifs conservés des protéines kinases.
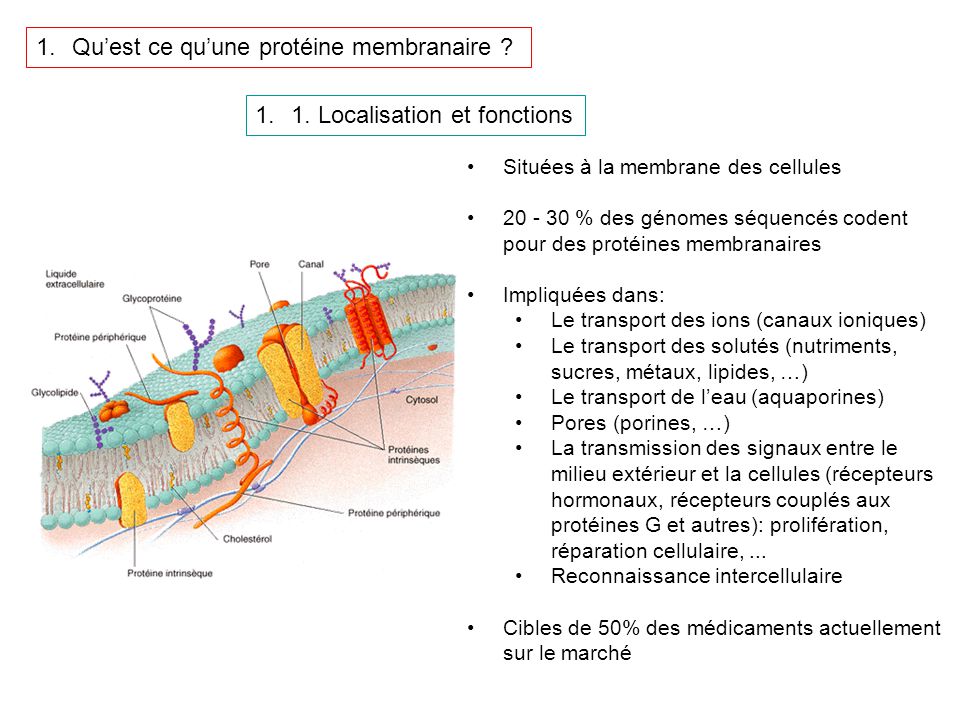
Figure E11 Représentation schématique de l'activation de protéine kinase. Régulation de Cdk2 Les kinases dépendant des cyclines coordonnent la progression de la cellule eucaryote lors de son cycle cellulaire prolifération cellulaire. Le but de ce devoir est d'élaborer différents protocoles afin de déterminer où la protéine se situe dans les cellules de l'hippocampe membrane, cytoplasme, etc Localisation de protéines dans la cellule Bonsoir, La notion de forme différente est assez vague.
Au final, ce que va reconnaitre un anticorps, c'est l'agencement 3D des acides aminés de surface de la protéine.
Bon, peu importe après tout! Une stratégie de purification serait: Après, la question qui va se poser c'est quelle stratégie de production pour l'anticorps. Si le domaine modifié est grand, on peut essayer une stratégie de polyclonal. Si seulement un seul acide aminé change et que la conformation 3D est bien préservée, il faut peut être tenter un monoclonal et tester les clones un à un en ELISA ou WB.
Je sers la science et c'est ma joie Localisation de protéines dans la cellule la réponse de piwi est rigoureuse et est une bonne base. Il y a plus simple selon les informations que vous avez, par exemple si vous avez cette fameuse séquence, on peut produire un anticorps à partir de peptides de synthèse. A voir en vidéo sur Futura. Localisation de protéines dans la cellule Merci beaucoup tout le monde, je crois que je vais bien réussir cet exercice grâce à vos conseils! Discussions similaires transport protéines d'une cellule à l'autre Par Vane14 dans le forum Biologie.
Système de localisation dans l'espace.